Kraven i EU:s MDR
Fresenius Medical Care har förbundit sig att säkerställa att alla våra medicintekniska produkter möter tillämpliga MDR-krav i enlighet med respektive övergångsperiod.
Många frågor uppstår beträffande MDR med avseende på:
-
Dess påverkan på den kontinuerliga tillgängligheten av produkter från Fresenius Medical Care
-
Information om dess tillämplighet för kunder och användare av våra medicintekniska produkter
På grund av omfattningen och komplexiteten av den nya MDR-förordningen, så implementeras de nya kraven enligt särskilda implementeringsprogram och kontrolleras av företagsledningen i nära koordination med vårt anmälda certifieringsorgan.
I följande avsnitt med vanliga frågor ges relevant information om hur Fresenius Medical Care ska implementera MDR och vilka konsekvenser det har för kunder och användare av våra medicintekniska produkter.
Uppfyller Fresenius Medical Care MDR-kraven?
Efterlevnaden av Fresenius Medical Cares kvalitetsstyrningssystem med tillämpliga MDR-krav utvärderades och bekräftades vid externa revisioner utförda 2019 av anmält certifieringsorgan. Sedan dess är vi föremål för regelbundna övervakningsrevisioner avseende efterlevnad av MDR.
En lika viktig förutsättning för att erhålla MDR-certifiering är produktkontrollen i den mening att kraven i MDR efterlevs. Efter framgångsrik utvärdering av anmält certifieringsorgan har den första produktkategorin inkluderats bland MDR-certifierade produkter. Antalet produkter som efterlever MDR kommer ständigt att öka under nästkommande år i linje med övergångsbestämmelserna för MDR.
Respektive EU-certifikat i överensstämmelse med MDR som har utfärdats av anmält certifieringsorgan kommer att uppdateras i respektive produktkategori.
Vilka är övergångsperioderna från det tidigare direktivet för medicintekniska produkter (MDD) till MDR som tillämpas för Fresenius Medical Care?
Se bilden nedan för allmänna tidsramar avseende övergång till MDR.
För särskilda riskklasser av medicintekniska produkter kan strängare tidsramar gälla i enlighet med tillämpliga bestämmelser.
Tidslinjerna för MDR är dock föremål för granskning och möjliga ändringar som EU-kommission anser är nödvändiga. Betydande exempel:
-
På grund av covid-19-krisen har EU-kommissionen skjutit upp tillämpningsdatumet för MDR med ett år till den 26 maj 2021 (förordning (EU) 2020/561)
-
Ytterligare en ändring av MDR, definierad som förordning (EU) 2023/607 publicerades 2023, där övergångstiderna för klass IIa och IIb (ej implanterbara) och Is+Im Medical Devices skjuts upp till december 2028 och för klass III och IIb (implanterbara) till december 2027 (om specifika villkor uppfylls). Dessutom avskaffades det tidigare uppskjutna försäljningsdatumet för MDD-produkter.
När kommer alla påverkade produkter från Fresenius Medical Care att efterleva de nya MDR-kraven?
Våra medicintekniska produkter kommer att släppas ut på EU-marknaden i enlighet med tillämpliga EU-krav under de lagligt definierade övergångsperioderna från det tidigare MDD till MDR.
Fram till slutet av december 2027/december 2028 (beroende på klassificeringen av den medicintekniska produkten), kan produkter som har certifierats enligt MDD under vissa förutsättningar fortfarande släppas ut på marknaden efter att MDR tillämpas fullt ut, så länge som deras EG-certifikat är giltiga.
Följdaktligen kommer Fresenius Medical Care att släppa ut både MDD- och MDR-certifierade medicintekniska produkter under denna period och fram till slutet av respektive övergångsperiod (se avsnittet "Övergångsperioder för MDR"), kommer Fresenius Medical Care-produkter med MDD-certifiering gradvis att certifieras enligt MDR. Anpassningar av FME-portföljen kan bli nödvändiga under denna fas.
Vilka ändringar avseende märkning förväntas för MDR-certifierade produkter?
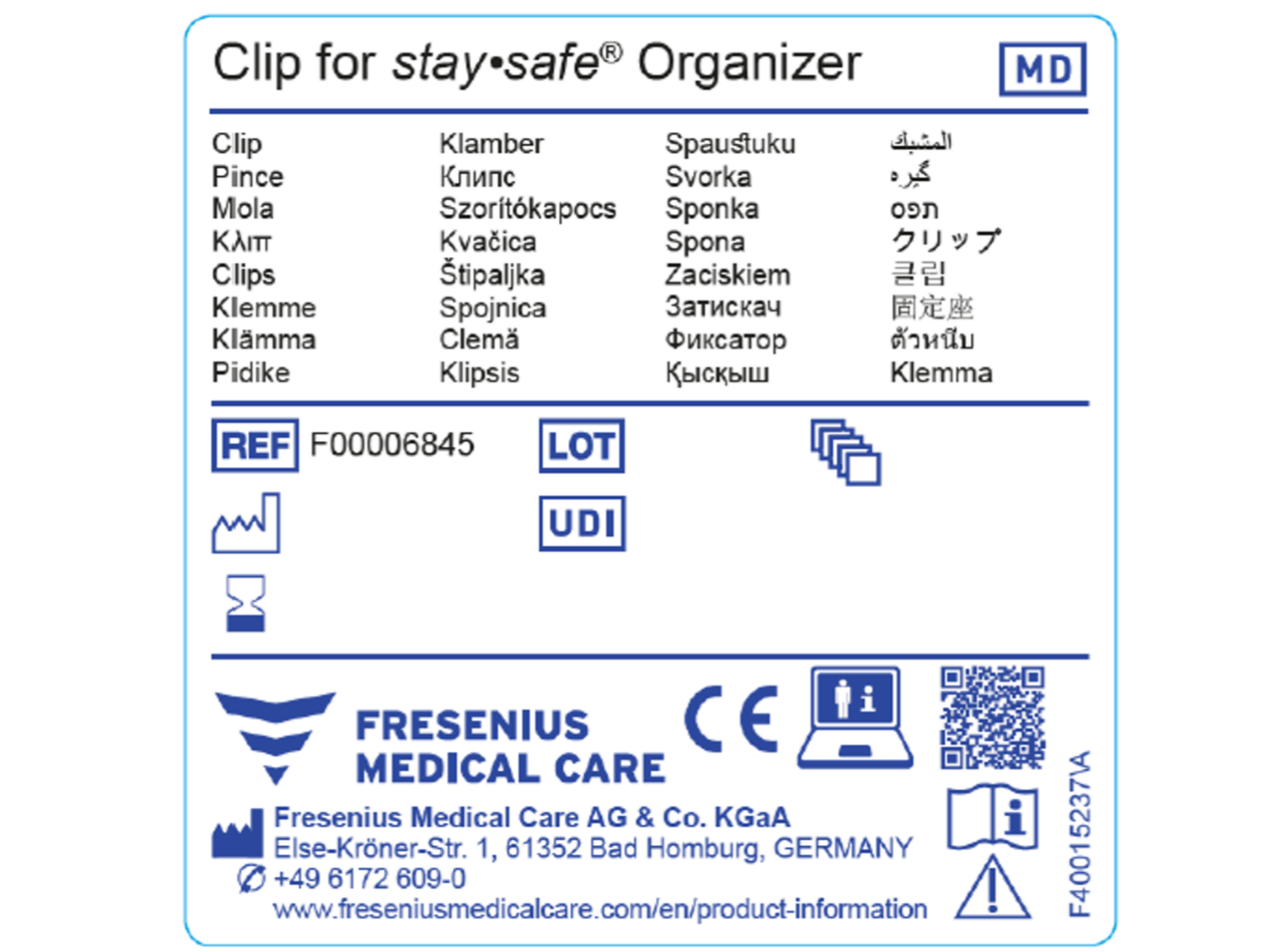
MDR-certifierade produkter kräver en unik produktidentifiering (UDI). UDI är en serie numeriska eller alfanumeriska tecken som möjliggör identifiering av en specifik produkt på marknaden. Specifika symboler behövs för MDR-certifierade produkter, exempel visas i den första illustrationen. UDI-koden på MDR-anpassade produkter ersätter inte artikelnumret, utan är till för produktidentifiering och spårbarhet under produktens hela livscykel*.
I den andra bilden hittar du ett exempel på en generisk etikett för efterlevnad av MDR.
I vilken omfattning måste kunderna säkerställa produktspårbarhet avseende våra medicintekniska produkter efter implementering av kravet på UDI-märkning?
MDR-certifierade produkter kräver en unik produktidentifiering (UDI). UDI är en serie numeriska eller alfanumeriska tecken som möjliggör identifiering av en specifik produkt på marknaden.
Relevanta tillämpliga skyldigheter för kunder beskrivs i EU-kommissionens faktablad (se länken i avsnittet nedan*) för;
-
unik produktidentifiering (UDI)
-
auktoriserade representanter, distributörer och importörer
-
sjukvårdspersonal och vårdinstitutioner
Vad har EUDAMED-databasen för relevans?
European Database on Medical Devices (EUDAMED) är en databas som hanteras av EU-kommissionen för lagring av information om medicintekniska produkter.
Målet med EUDAMED är att stärka övervakningen av marknaden genom att ge behöriga myndigheter snabb åtkomst till information om tillverkare, auktoriserade representanter, medicintekniska produkter, certifikat och övervakningsdata samt att dela information från kliniska prövningar för att bidra till en enhetlig tillämpning av tillsynskrav, särskilt i avseende med krav på registrering.
Alla tillverkare och alla medicintekniska produkter som finns på EU-marknaden måste vara registrerade i EUDAMED. Tillverkare (som Fresenius Medical Care) måste säkerställa att alla uppgifter som tillhandahålls EUDAMED är korrekta och uppdaterade. Uppgifter inkluderar produktrelaterad information, data från olika marknadskontrollrapporter och uppgifter om den registrerade ekonomiska aktören.
Fresenius Medical Care måste uppfylla kraven på registrering i EUDAMED och rapportera inom de tidsramar som fastställts enligt lag.
För MDR-certifierade produkter från Fresenius Medical Care kommer användarinstruktioner att tillhandahållas online, utöver den tryckta versionen. Användarinstruktioner för MDR-certifierade produkter hittar du här.
Information och faktablad från EU-kommissionen
Gör en snabbsökning för att hitta följande dokument:
- EU-förordning 2017/745 (MDR)
Se även följande länkar:
- Översikt av flera faktablad och guider (se även nedan)
- Faktablad för tillverkare av medicintekniska produkter
- Faktablad om UDI (PDF)
- Faktablad för sjukvårdspersonal och vårdinstitutioner
- Faktablad för behöriga myndigheter i länder utanför EU/EES
Information och faktablad från andra källor
Branschorganisationer och offentliga myndigheter för allmän information om MDR: